배터리는 간단한 화학 반응, 일반적으로 세 가지 원소 사이에서 일어나는 반응을 원리로 작동합니다. 이러한 물질들 사이의 반응으로 인해 전류가 생성됩니다. 이것이 배터리의 핵심 원리입니다.
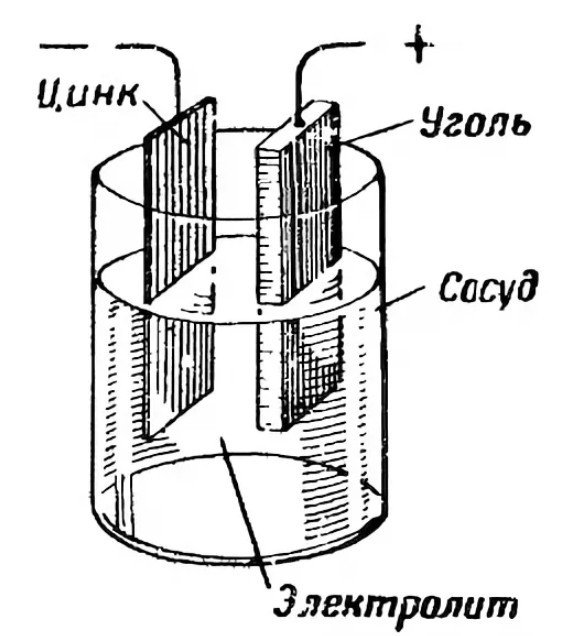
세 가지 핵심 요소:
- 양극 "+"
- 음극 "-"
- 전해질
양극 또는 정극은 전자의 공급원 역할을 합니다. 일반적으로 아연으로 만들어집니다. 두 전극은 전해질을 통해 서로 반응합니다. 전해질은 보통 염, 염화암모늄 또는 알칼리입니다. 고체 또는 액체일 수 있습니다. 제조업체는 전해질의 점도를 높이기 위해 고분자 화합물을 첨가하기도 합니다. 전분을 사용하는 경우도 있습니다.
배터리는 어떻게 작동할까요?
배터리에는 양극에서 음극으로 전류가 흐릅니다. 이는 배터리에 부하가 연결될 때 발생합니다. 양극과 음극 단자를 전선으로 직접 연결하면 단락이 발생하여 배터리가 빠르게 방전되고 화재까지 발생할 수 있습니다.
음극은 환원제 역할을 하며 양극으로부터 전자를 얻습니다. 전해질 환경에서 이온은 자유롭게 이동하여 효율적인 전류 생성을 촉진합니다.
화학적으로 어떤 일이 일어나고 있는 걸까요?
예를 들어 유리에서 용량황산 용액을 붓고 그 안에 아연 막대를 넣어 봅시다. 아연 막대 표면에는 양전하를 띤 이온이 존재합니다. 용액 속의 음이온은 아연 막대 주위에 모입니다. 용액은 인력을 발휘하여 아연 이온을 쉽게 떼어냅니다. 결과적으로 용액은 양전하를 띠고, 아연 막대는 음전하를 띠게 됩니다. 물리 법칙에 따르면 전위차는 전압과 같습니다. 이것이 바로 전류를 발생시키는 원리입니다.
결과적으로 산성 용액과 금속이 접촉하면 계면에 전기장이 생성됩니다. 이때 화학 에너지가 전기 에너지로 변환됩니다. 이것이 바로 배터리의 작동 원리입니다.
시간이 지나면 배터리 수명은 줄어들게 됩니다. 이는 전원을 어디서 어떻게 사용하는지에 따라 달라집니다. 예를 들어 손전등에 사용하는 경우, 적당히 사용한다면 1.5볼트 배터리 두 개로 한 달 정도 사용할 수 있습니다. 하지만 같은 배터리를 전기 자동차에 넣으면 몇 시간밖에 운행하지 못할 것입니다.
이러한 모든 것을 종합해 볼 때, 부하가 클수록 배터리 방전 속도가 빨라진다는 결론을 내릴 수 있습니다.
다음 글도 읽어보세요: